Al
consultar la influencia de los distintos abonos en el valor de la
conductividad eléctrica de las soluciones nutritivas suelen
encontrarse datos dispares dependiendo de la fuente consultada. Esto
es debido a que dicho valor no es constante y depende de las
características de la disolución en el momento de realizar las
mediciones.
La
conductividad es una propiedad que mide la facilidad con que los
iones se mueven bajo la acción de un campo eléctrico. Debido a que
algunos iones poseen carga múltiple, la cantidad de corriente que
pueden transportar, para un tamaño iónico dado, es mayor. Así que,
desde este punto de vista, el valor de la conductividad depende, por
un lado del número de iones presentes, y por otro lado del número
de cargas totales que tengan esos iones. La conductividad molar hace
referencia a la conductividad aportada por un mol de un ion o
molécula específica y la conductividad equivalente, como su propio
nombre indica, es la conductividad aportada por un equivalente de
dicha sustancia. Para iones con una sola carga el valor de las
conductividades molares y equivalentes es el mismo y para los iones
bivalentes la conductividad molar es el doble de la conductividad
equivalente. La conductividad iónica equivalente a dilución
infinita es un valor constante para cada ion y se determina matemáticamente a partir de principios y leyes que regulan los
electrolitos.
 |
| Tabla nº 1 |
La tabla nº 1 muestra este valor para los iones que
normalmente entran a formar parte de las soluciones nutritivas.
Debido a la interacción entre los iones, la conductividad no es
directamente proporcional a la concentración iónica. La
conductividad equivalente de una sustancia disminuye a medida que
aumenta la concentración. Por ejemplo, para el cloruro sódico, la
conductividad equivalente a dilución infinita es de 0,1264 dS/m
(0,0763+0,0501), pero para una concentración de 1 meq/L es de 0,1237
dS/m y para una concentración de 100 meq/L es de 0,1067 dS/m. Esto
quiere decir que al multiplicar por 100 la concentración de cloruro
sódico la conductividad no es 100 veces mayor (12,37 dS/m), sino
solo de 10,67 dS/m (100x0,1067). Los valores de la conductividad
específica a distintas concentraciones solo pueden ser obtenidos por
medición directa en laboratorio y esta es la razón por la que
pueden ser encontrados valores distintos según sea la fuente
consultada.
 |
| Gráfica nº 1 |
Cuando
en las disoluciones hay mezclas de iones provenientes de distintas
sales las interacciones entre ellos son mucho mas complejas. En estos
casos el uso de coeficientes empíricos para el cálculo de la
conductividad de las soluciones nutritivas, aunque necesarios e
imprescindibles, requieren de una cuidadosa elección respecto de la
fiabilidad de la fuente. Como ejemplo se muestra en la gráfica nº 1
la relación entre la conductividad calculada, aplicando los valores
de la conductividad equivalente mostrados en la tabla nº 1, y la
conductividad medida en laboratorio para 11 aguas de riego de
Almería.
 |
| Gráfica nº 2 |
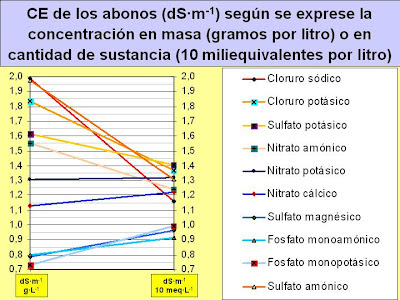
Las
referencias bibliográficas suelen presentar los datos de
conductividad de los abonos en función de su concentración
expresada en gramos por litro. La gráfica nº 2 muestra, en el eje de la izquierda, el valor medio de distintos datos encontrados en
fuentes especializadas. Se
ha añadido, en el eje de la derecha, los
valores de conductividad expresados en cantidad de sustancia (10
meq/L). Puede apreciarse que las diferencias de conductividad
aportada por los distintos abonos no son tan distintas como aparentan
ser cuando este valor se expresa en términos de conductividad
equivalente. Un ejemplo típico es el cloruro sódico. De las sales
mostradas es la de mayor aportación salina si se expresa la
concentración en g/L, pero resulta ser menos salina que el nitrato
potásico o el nitrato cálcico, entre otros, si su concentración se
expresa en meq/L.
 |
| Tabla nº 2 |
Finalmente
en la tabla nº 2 se muestra un resumen de los iones que componen los
abonos de uso común con alguna de sus características y sus valores
de conductividad molar y equivalente. El valor de la conductividad
molar permite el cálculo de la conductividad de las soluciones
nutritivas si se expresan las concentraciones en mmol/L. Siempre es
aconsejable, para determinar la conductividad de la solución
nutritiva en gotero, calcular la conductividad aportada por los
fertilizantes y, a este valor, sumarle la conductividad medida del
agua de riego. No debe de calcularse la conductividad del agua de
riego. Como el agua de riego es tangible lo mejor es medir su
conductividad.
Cuando
en las soluciones nutritivas entrar a formar parte más de dos abonos
pueden utilizarse coeficientes que simplifiquen el proceso del
cálculo de la conductividad. Para ello existen distintos métodos.
Particularmente es muy recomendable, por su sencillez y relativa
exactitud, calcular la conductividad aportada por los fertilizantes
sumando los meq/L de los cationes aportados, sin contabilizar los
protones aportados por los ácidos, y dividir este valor entre 9. Al
valor de la conductividad obtenido, que estará expresado en dS/m, se
le suma la conductividad que se haya medido del agua de riego y se
tendrá la conductividad total y final de la solución nutritiva en
gotero.

ya que hablamos de salinidad....alguno me puede informar la postura del tomate kumato,es mejor una y aguantarla hasta marzo o 2 posturas una otoño y otra en primavera?....y si alguien me puede informar sobre el tomate arawak,es tipo corazon de buey?...
ResponderEliminarSaludos A por ellos;
ResponderEliminarsi miramos la tabla nº2; vemos que para 1mmol/l de nitrato potásico la CE correspondiente sería 0,13; y para el nitráto potásico sería la CE de 0,24. Sería lineal la correspondencia; es decir 2mmol/l de nitrato potásico corresponderían a una CE de 0,26 y 2mmol/l de nitrato potásico una CE de 0,48?
Obervando esta tabla; en referencia a mmol/l (no a la cantidad de gr/l de sal aportada); el índice de salinidad o la mayor salinidad vendría aportado por el sulfato potásico, seguido del sulfato amónico y nitrato cálcico.
Antonio tu pregunta es un poco confusa. Además te refieres al nitrato potásico dos veces, supongo que quieres comparar el potásico con el cálcico. De todas formas intento aclarar con los siguientes ejemplos.
EliminarSi se prepara una SN con 5 mmol/L de nitrato potásico se tendrá que pesar 505 mg/L (5x101), y en esta SN habrá 5 mmol/L de nitratos y 5 mmol/L de potasio y como la carga eléctrica de estos iones es 1 habrá, por lo tanto, 5 meq/L de nitrato y 5 meq/L de potasio y la conductividad de esta disolución será de 0,65 dS/m (0,13x5).
Si se prepara una SN con 2,5 mmol/L de nitrato cálcico se tendrá que pesar 540 mg/L (2,5x216) , y en esta SN habrá 5 mmol/L de nitrato y 2,5 mmol/L de calcio (por simplificar se está obviando el nitrato amónico que tiene el nitrato de cal de uso común) y como la carga eléctrica del nitrato es 1 y la del calcio es 2 habrá, por lo tanto, 5 meq/L de nitrato y 5 meq/L de calcio y la conductividad de esta disolución será de 0,6 dS/m (0,24x2,5 si usas la conductividad molar o 0,12x5 si usas la conductividad equivalente).
Saludos, A por ellos.
EliminarMe refería precisamente a los datos necesarios para poder determinar la conductividad específica que aporta cada sal de forma individual, según la cantidad de sustancia aportada. Y se obtine de la tabla nº2
Gracias por la aclaración.
Un saludo
Nada mas que por lo que vale la semilla y el precio al que está el tomate... Mi consejo es que pongas una sola postura.
ResponderEliminarYA ME HAN INFORMADO QUE EL KUMATO,ES INJERTADO Y MEJOR 2 COSECHAS QUE UNA,DE HECHO YO CREO QUE LO HAGA ASIN,AHORA EL TOMATE ARAWAK,NO LO CONOCE NINGUN PERITO AL CUAL YO LE HAYA PREGUNTADO,HABER SI ALGUNO DE POR AQUI ME PUEDE INFORMAR?...GRACIAS
ResponderEliminarQue CE suben los tiosulfatos KTS y CaTs??
ResponderEliminarKts o.7
EliminarCaTs 0.3